化学中能判断反应能否自发进行的是
判断反应能否自发进行由该公式确定:△G=△H-T△S。△G为吉布斯自由能变,△H为焓变,△S为衍堠以四熵变,T为开氏温度。
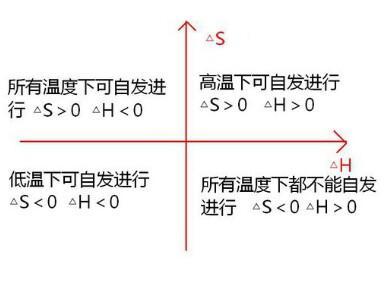
在温度、压强一定的条件下,化学反应的判读依据为:
ΔH-TΔS<0 反应能自发进行
ΔH-TΔS=0 反应达到平衡状态
ΔH-TΔS>0 反应不能自发进行
注意:(1)ΔH为负,ΔS为正时,任何温度反应都能自发进行
(2)ΔH为正,ΔS为负时,任何温度反应都不能自发进行
扩展资料
在ΔG=ΔH-TΔS中,焓变和熵变的值是通过末状态减初状态得出的,所以自由能变也应该用末状态减初状态。我们所说的一个化学反应方程式只有一个焓变和熵变,分别是标准摩尔反应焓变和标准摩尔反应熵变,计算得到的是标准摩尔反应吉布斯自由能变。
而由于实际投料的不同,摩尔反应吉布斯自由能变与标准摩尔反应吉布斯自由能变会有一个差值,这个差值就是RTlnQ(对于这个差值我们之后会说到)。对于可逆反应来说,末状态并不是完全反应的状态,所以不能用标准反应的值来算。
参考资料来源:百度百科-自发反应
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。