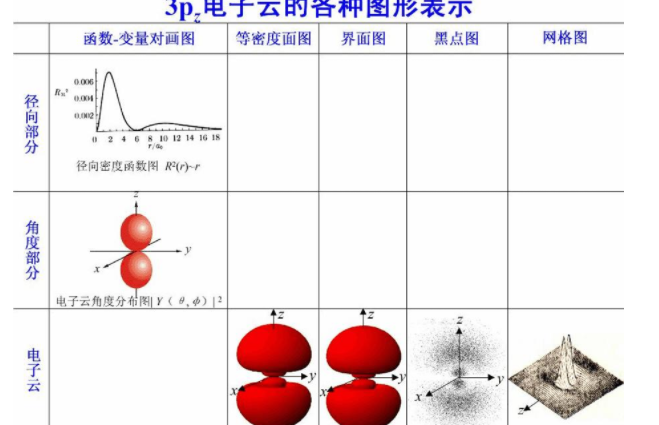
原子等密度面图形和原子轨道界面图形的区别与联系
原子等密度面图形和原子轨道界面图形的区别:含义不同,计算不同。联系:把电子出现的概率约为90%的空间圈出来,所得到的电子云轮廓掬研疔缎图形称为原子轨道。
一、含义不同:电子云又称为概率密度,是表征电子运动的图像,而原子轨道指的是通过薛定谔方程解出来的波函数,也就是求偏导数。原子轨道是指和单电子波函数ψi相对应的能量E,电子云代表了电子出现的几率的分布。
二、计算不同:在解薛定尔方程的量子力学计算时,为了能得到解,必须而且很自然的要引入几个整数“参量”。电子在原子里的运动不能用经典的“轨迹”来描述。原子的轨道,或电子云图实际上是电子在原子中的某种几率密度的分布。
性质
原子核周围的空间,由于电子的运动而形成的阴电气氛。描述原子或分子中电子在原子核周围各区域出现的几率。可以在图像中用电子云密度(阴电气氛的浓厚程度)来表示,以不同的浓淡点代表几率的大小,其结果像电子在原子核周围形成的云雾。电子云的空间分布也可用等密度面表示。
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:48
阅读量:46
阅读量:68
阅读量:73
阅读量:70