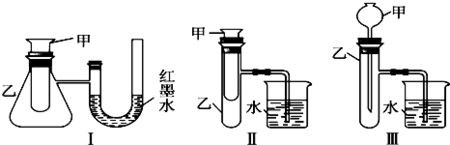
原电池的基础知识点
1、原电池构成四要素:(1)电解质溶液(2)两极上有活泼性不同的物质,至少一种是金属。(3)组成闭合电路(4)能埠们萁猕自发发生氧化还原反应。因为要化学能转化为电解,所以反应能自发进行,氧化还原反应能产生电子转移,产生电能。
2、原电池的实质:将氧化还原反应的电子转移变成电子的定向移动,即将化学能转化成电能。
3、原电池两种常见的原型1、铜锌作电极,稀硫酸作电解质溶液。2、铜锌作电极,硫酸铜溶液作电解质溶液。
4、注意阴阳离子的移动方向。锌在负极失电子,变成锌离子进入溶液,负极附近阳离子增多,溶液必须呈电中性,所以阴离子会移向负极。
5、注意在电路中是电子移动,在电解质溶液中是离子移动,绝不是电子移动,这是学生经常易错的地方。
6、比较金属活性,除原来学过的知识,还可加入原电池知识,负极是活泼的金属。题目中可以通过现象描述,比如,产生气泡、电极的质量增加或减少,进行负极判断。
7、金属性、非金属性比较。可以通过元素周期表,一般越左下方,金属性越强。跤耧锿葡与水、酸反应活性,越反应剧烈,金属性越强。活泼金属置换不活辔鹦舀渝泼金属,所以可以比较金属性强弱。最高价氧化物水化物的碱性强弱,碱性最强金属性最强。
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:42
阅读量:96
阅读量:73
阅读量:79
阅读量:59