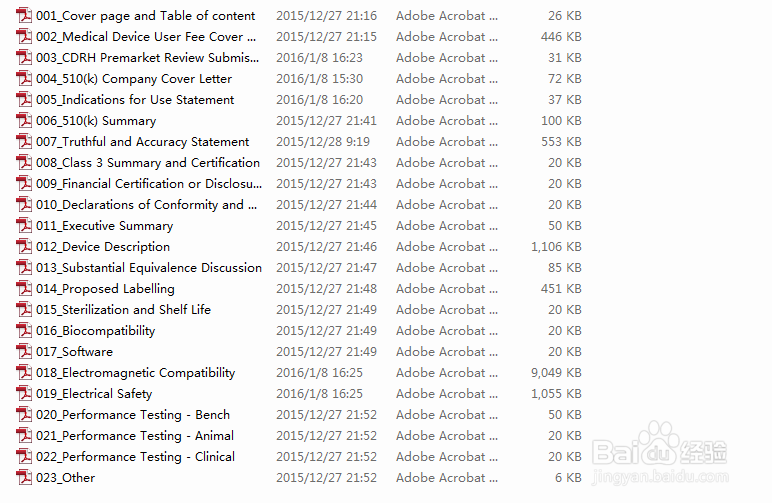
如何准备510(K)申请文件
1、申请函,踊辽嚏囱此部分应包括申请人(或联系人)和企业的基本信息,510(K)递交的目的,申请上市器械的名称、型号和分类资料,进行实质等效比较的产品(PredicateDevice, 即目前已合法上市的产品)名称及其510(K)号码;
2、目录,即510(K)文件中所含全部资料的清单(包括附件);
3、真实性保证声明,对此声明,FDA有一个标准的样本;器材名称,即产品通用名、FDA分类名、产品贸易名;
4、注册号码,如企业在递交510(K)时已进行企业注册, 则应给出注册信息,若未注册,也予注明
5、分类,即产品的分类组、类别、管理号和产品代码;
6、性能标准,产品所满足的强制性标准或自愿性标准;
7、产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
8、实质相等性比较(SE);
9、510(K)摘要或声明;
10、产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
11、产品的安全性与有效性,包括各种设计、测试资料;
12、生物相容性;
13、色素添加剂(如适用);
14、软件验证(如适用);
15、 灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:28
阅读量:52
阅读量:29
阅读量:72
阅读量:72