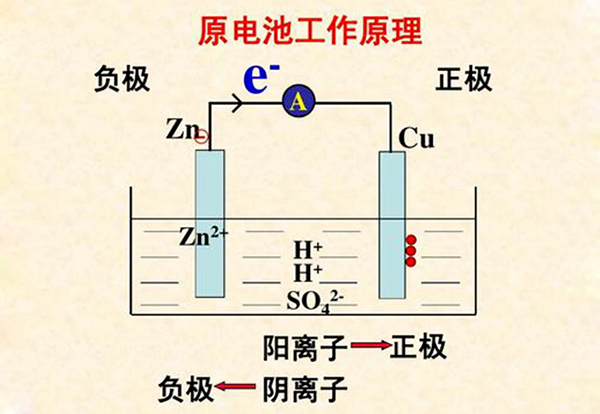
原电池中电子电流的移动方向是怎样的,及怎样判断正负极
原电池中电子是由负极浯裁佻辞流向正极,电流是由正极流向负极。
电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应,原电池就是通过化学反应实现化学能向电能转化的。
原电池正负电极的判断
(1)根据电极材料:较活泼一极为负,较不活泼的一极为正(与电解质反应得失电子);
(2)根据两极发生的反应:发生氧化反应的一极为负,还原反应的一极为正;
(3)根据电子或电流流动方向:电流方向由正→负,电子流向由负→正;
(4)根据溶液中离子运动方向:阴离子移向的一极为负,阳离子移向的一极为正。
扩展资料
组成原电池的条件:
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极;
(2)电极材料均插入电解质溶液中;
(3)两极相连形成闭合电路;
(4)内部条件:能自发进行氧化还原反应。
原电池是利用两个电极的电势不同,产生电势差,从而使电子流动产生电流,是一种将化学能转化成电能的装置。由于各种型号的原电池氧化还原反应的可逆性很差,放完电后,不能重复使用,故又称为一次电池。
一次电池只可放电一次,当内里的化学物质全部起了化学作用后便不能再能提供电能,也不能将外部提供的电力储起,因此完全放电后便不可再用,这是因为其电化反应不可逆转。
参考资料来源:百度百科--原电池
参考资料来源:百度百科--原电池反应
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。